Wasser ist (nicht nur) zum Waschen da!
Thomas Wollstein
Dezember 2002
Man nehme...
Die Hauptzutat fotografischer Lösungen ist - richtig:
Wasser
In den meisten Fällen reicht normales Leitungswasser, Trinkwasser, aus, da dieses in Deutschland von recht hoher, gesetzlich geregelter Qualität ist. Aber: auch Stoffe, die im Trinkwasser zugelassen sind, weil sie gesundheitlich unbedenklich sind, z.B. Kalzium- und Magnesiumsalze, können die im Zuge der Verarbeitung ablaufenden chemischen Reaktionen beeinflussen. Die Hersteller fotografischer Lösungen versuchen durch Hilfsstoffe z.B. die Wasserhärte - eben jene Kalzium- und Magnesiumsalze - zu maskieren, so dass sie die Verarbeitung nicht stören. So lange die Zusammensetzung des Wassers konstant ist, ist auch die durch Beimengungen verursachte Beeinflussung konstant und stört nicht, wenn man seine Verarbeitung selbst kalibriert hat. Störend sind Prozessschwankungen durch Änderungen der Wasserqualität, weil man bei der Aufnahme dann nie weiß, was bei der Verarbeitung mit dem Bild passieren wird.
Folgende Empfehlungen sollte man beherzigen, wenn man auf der sicheren Seite liegen möchte:
- Leitungswasser für Fixierbäder
- Schwebstofffreies Wasser für die meisten alkalischen Entwickler und Abschwächerlösungen
- Demineralisiertes Wasser für Feinkornentwickler und Verstärkerlösungen sowie auf jeden Fall für Toner
Wenn das vorhandene Leitungswasser extrem hart ist (Auskunft dazu können die lokalen Wasserwerke geben.) und demineralisiertes Wasser nicht verfügbar ist, kann man sich helfen, indem man Leitungswasser für 20 Minuten kochen lässt. Das fällt praktisch die gesamte Wasserhärte in Form unlöslicher Niederschläge aus und treibt alle gelösten Gase aus.
Filtern nach dem Abkühlen entfernt die ausgefällten Niederschläge. (Man sollte allerdings nur im Notfall zu dieser Lösung greifen, da die Kocherei ziemlich viel Energie verschlingt und das so gereinigte Wasser teuer und wenig umweltfreundlich macht. Lange dauern tut´s auch: 20 min Kochen plus ein Vielfaches davon, bis das Wasser so kühl ist, dass man es zum Ansatz verwenden kann.)
Konzentration ist alles
Die Stärke einer Lösung ist ihre Konzentration oder auch Verdünnung. Am verbreitetsten sind
Konzentrationsangaben in Teilen
Beispiele sind etwa Entwicklerverdünnungen wie 1+4 oder 1:4. Dabei sind die beiden Angaben nicht gleichwertig:
1+4 bedeutet, dass sich die Gesamtmenge aus 5 Teilen zusammensetzt, nämlich 1 Teil Konzentrat plus 4 Teile Wasser.
1:4 bedeutet, dass die Gesamtmenge aus 4 Teilen besteht, von denen 1 Teil Konzentrat ist.
Man sieht schnell, dass die beiden Angaben umrechenbar sind: 1+4 ist gleichwertig mit 1:5.
Bei großen Gesamtmengen, z.B. einem Ansatz von 1+100, ist der Unterschied natürlich marginal.
Konzentrationen in Prozent
Wenn die Rede ist von einer 2%igen Natriumsulfitlösung (z.B. als bewährte Wässerungshilfe), ist die Frage, "2% von was?". Solche Lösungen sind ein typisches Beispiel für den Vergleich von Äpfeln mit Birnen. Gemeint ist nämlich: Man nehme 20 g (also eine bestimmte Masse) Natriumsulfit, löse diese in Wasser auf, das man dann auf 1 l (also ein bestimmtes Volumen) auffüllt. Die Angabe sind also "Prozent Gewicht je Endvolumen" (engl.: % w/v für weight/volume).
Entsprechend ist es überraschenderweise möglich, mehr als 100%ige Lösungen zu erzeugen, wenn die gelöste Substanz sehr gut löslich ist. Man kann z.B. eine 100%ige Natriumthiosulfatlösung bereiten, indem man 100 g Natriumthiosulfat in Wasser auflöst und auf 100 ml verdünnt.
Wenn man von einer vorhandenen konzentrierten Lösung ausgeht, die verdünnt werden soll, ist es gebräuchlich, Volumenprozent (engl.: % v/v für volume/volume) als Konzentrationsangabe zu benutzen: Für eine 10%ige Lösung einer Flüssigkeit A nehme man 10 ml von A und verdünne auf 100 ml Lösung.
Beispiel: Eine 2%ige Essigsäure bekomme ich, wenn ich 2 ml Eisessig (konz. Essigsäure) auf 100 ml Lösung auffülle. (Tatsächlich enthält Eisessig aber rund ein halbes Prozent Wasser, so dass die Lösung nicht genau 2%ig ist, aber für alle praktischen Zwecke ist die Angabe genau genug.)
Die Krise bekommen viele Laboranten, wenn von ihnen z.B. verlangt wird, aus 28%iger Essigsäure (die viel weniger gefährlich in der Handhabung ist als Eisessig), eine 10%ige Lösung anzusetzen. Hier hilft die
Kreuzmischregel
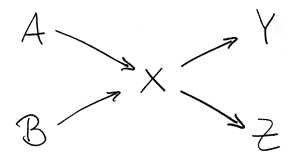
Dabei ist:
A die prozentuale Konzentration der zu verdünnenden Lösung
B prozentuale Konzentration der zum Verdünnen verwendeten Lösung (bei Wasser B = 0)
X prozentuale Konzentration der gewünschten Lösung
Y = X-B das zu verwendende Volumen der zu verdünnenden Lösung
Z = A-X das zu verwendende Volumen des "Verdünnungsmittels"
Klartext: Y ml Lösung der prozentualen Konzentration A plus Z ml Lösung der prozentualen Stärke B ergeben eine Lösung der gewünschten prozentualen Konzentration X.
Beispiel: Die genannte 28%ige Essigsäure soll mit Wasser auf 10% verdünnt werden.
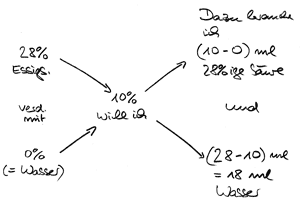
Also geben 10 ml 28%iger Essigsäure plus 18 ml Wasser eine 10%ige Essigsäure.
Wasser und Säure - da wird es bei einigen klingeln. Da war doch dieser Spruch im Chemieunterricht:
"Gießt du Wasser auf die Säure, dann geschieht das Ungeheure!"
Der Reim klingt harmloser als er ist: Bei der Mischung von Wasser und Säure wird durch eine chemische Reaktion Energie frei, die dazu führt, dass sich die Mischung erwärmt. Ist die Säure sehr konzentriert und kommt nur wenig Wasser dazu, so wird auf engem Raum sehr schnell sehr viel Energie frei gesetzt. Die Folge ist, dass sich an dieser Stelle die Mischung plötzlich so weit erhitzt, dass das Wasser schlagartig verdampfen kann. Dann spritzt es möglicherweise, und was da spritzt ist nicht nur Wasser, sondern auch die konzentrierte Säure.
Die Situation ist entschärft, wenn man Säure auf Wasser gießt. Warum? Es ist viel Wasser da, in dem sich die Säuremoleküle und die entstehende Wärme gut verteilen können. Man gießt also ein wenig Säure langsam in viel Wasser. Dann passiert nichts Schlimmes.
Der Spruch gilt übrigens in gleicher Weise für starke Basen: Auch bei der Zugabe von Wasser z.B. zu Natriumhydroxid kann es zu explosionsartigem Sieden des Wassers kommen. Verlust des Augenlichts und Verätzungen (teilweise mit bleibenden Vernarbungen) können die Folgen solcher Achtlosigkeit sein.
Das Thema
Sicherheit im privaten Umfeld
ist überhaupt ein trauriges. Im beruflichen Umfeld ist durch arbeitsrechtliche Vorschriften in aller Regel gut für die Sicherheit von Arbeitnehmern gesorgt, doch daheim sieht es anders aus: Nicht nur, dass es keinen Sicherheitsingenieur gibt, der auf die Einhaltung der Sicherheitsvorgaben achtet. Zu allem Überfluss sind es oft auch noch unzureichend ausgebildete Leute, die mit den gefährlichsten Substanzen hantieren. Der am Arbeitsplatz durch Vorschriften und ggf. Aufpasser gut beschützte Chemielaborant hat im Rahmen seiner Ausbildung gelernt, mit Gefahrstoffen umzugehen, der nicht geschulte "Künstler" in der Dunkelkammer aber nicht. So wundert es nicht, dass daheim viele, teilweise fatale, Unfälle passieren.
Um das Ganze abzurunden, finden es viele Leute auch noch ausgesprochen "cool", sich wissentlich Gefahren auszusetzen. Sind doch alles Memmen, die beim Hantieren mit Chemikalien Handschuhe und Schutzbrille tragen oder ihre Finger nicht in den Entwickler, möglichst Pyro, tauchen wollen. Wer derart spätpubertär anmutende Äußerungen von sich gibt, kann mir nur leid tun.
Wenn Sie nicht wissen, welche Gefahren ein Stoff birgt,
behandeln Sie ihn in Ihrem eigenen Interesse mit Respekt!
Zwar werden die Bilder der meisten Künstler erst nach dem Tod der Künstler richtig wertvoll, aber die Künstler haben dann nichts mehr davon, und die Nachkommen hätten vielleicht auch mehr von Vater oder Mutter als vom Geld für deren Bilder.
(Nachtrag: Meine Frau meint, ich solle Ihnen nicht gleich Ihr baldiges Ableben in Aussicht stellen. So dramatisch sei es doch vielleicht nicht. Sie hat Recht: Sie werden nicht morgen sterben, wenn Sie heute Ihre Finger Hydrochinon oder Pyrogallol enthaltende Entwickler tauchen. Allerdings steigen Ihre Chancen auf gesundheitliche Spätfolgen dramatisch an. Insofern bitte ich Sie, mir meinen Hang zum Zynismus nachzusehen.)
Verschiedene Formen einer Substanz
Manche Fotochemikalien kommen in verschiedenen Formen vor. Beispiele sind Soda sicc., Soda-Monohydrat und Soda krist. (Dekahydrat). Der Unterschied ist hier der Wassergehalt: Soda sicc. ist die wasserfreie Form und enthält kein Kristallwasser. Soda-Monohydrat enthält je Sodamolekül ein Wassermolekül und Soda krist. (Kristallsoda oder Dekahydrat) je Sodamolekül 10 Wassermoleküle. Wenn ich also von jedem dieser drei Stoffe 10 g auf der Waage habe, habe ich nur im ersten Fall 10 g Wirksubstanz, bei den Formen mit Kristallwasser um so weniger, je mehr Wasser enthalten ist. Für einige häufig vorkommende Substanzen ist in der nachfolgenden Tabelle aufgelistet, wie man die Mengen umrechnen muss, wenn man die eine durch die andere ersetzt.
|
Substanz |
Diese Menge wasserfreie Form ist zu ersetzen durch |
diese Menge Gramm des Monohydrats |
oder diese Menge der kristallinen Form |
|
Soda |
1 |
1,17 |
2,7 |
|
Natriumsulfit |
1 |
2 |
|
|
Natriumsulfat |
1 |
2,3 |
|
|
Natriumthiosulfat |
1 |
1,6 |
Die kristallinen Formen, inbesondere von Natriumthiosulfat, das sehr gut in Wasser löslich ist, können interessante Wirkungen haben: Löst man sie in Wasser auf, so kühlt sich die Lösung stark ab. Dieser Abkühlungsvorgang kann beim Auflösen größerer Mengen so weit gehen, dass die Lösung gefriert und den Behälter, in dem man mischt, zum Platzen bringt. Es empfiehlt sich also, auch um Zeit zu sparen, zum Ansatz warmes Wasser zu verwenden, denn in kaltem Wasser lösen sich Kristalle nur sehr langsam.
Bei Auflösen der wasserfreien Formen in Wasser dagegen wird Wärme frei (vgl. Wasser auf Säure), und hier empfiehlt es sich folgerichtig, kaltes Wasser zu verwenden und immer die Wirksubstanz zum Wasser zu geben und nicht umgekehrt.
Temperaturumrechnung
In der Schule hat man Sie im Physikunterricht sicher mit der Kelvinskala gequält, und die meisten wissen, dass man von einer Temperatur in Kelvin (nicht: Grad Kelvin! Abgekürzt nur mit K, nicht °K) nur 273 (genauer 273,15) abziehen muss, um die Temperatur in Grad Celsius (°C) zu erhalten. Kelvin in Grad Celsius ist leicht umzurechnen, aber in der Fotografie leider unüblich.
Häufig kommt dagegen das in den USA noch immer übliche Grad Fahrenheit (°F) vor. Auf der Fahrenheit-Skala gefriert Wasser bei 32°F und kocht bei 212°F. Damit ist eigentlich alles gesagt.
Na gut, sagen wir es konkreter:
Um von °F in °C umzurechnen, subtrahieren Sie 32 und teilen Sie durch 1,8.
Um von °C in °F umzurechnen, multiplizieren Sie mit 1,8 und addieren Sie 32.
Damit ist klar: Die Standardtemperatur fotografischer Lösungen von 20°C wird auf der anderen Seite des großen Teiches 68°F betragen, ohne deswegen wärmer zu sein.
Literatur
Die meisten dieser Zusammenhänge sind zusammengestellt in:
Grant Haist, Modern Photographic Processing, Vol. 1, Wiley Interscience (Wiley Series on photographic sciences and technology), 1979, ISBN 0-471-02228-4
[m.W. leider lange vergriffen und nur noch in Antiquariaten zu haben]